清源創(chuàng)新實(shí)驗(yàn)室生物分析與納米醫(yī)學(xué)科研團(tuán)隊(duì)負(fù)責(zé)人楊黃浩教授課題組成員張進(jìn)教授、林延帶碩士研究生、宋繼彬教授與中科院長春應(yīng)化所丁建勛研究員課題組合作綜述了一種刺激響應(yīng)型納米粒子用于可控藥物釋放實(shí)現(xiàn)腫瘤協(xié)同免疫治療的進(jìn)展Advanced Science上。

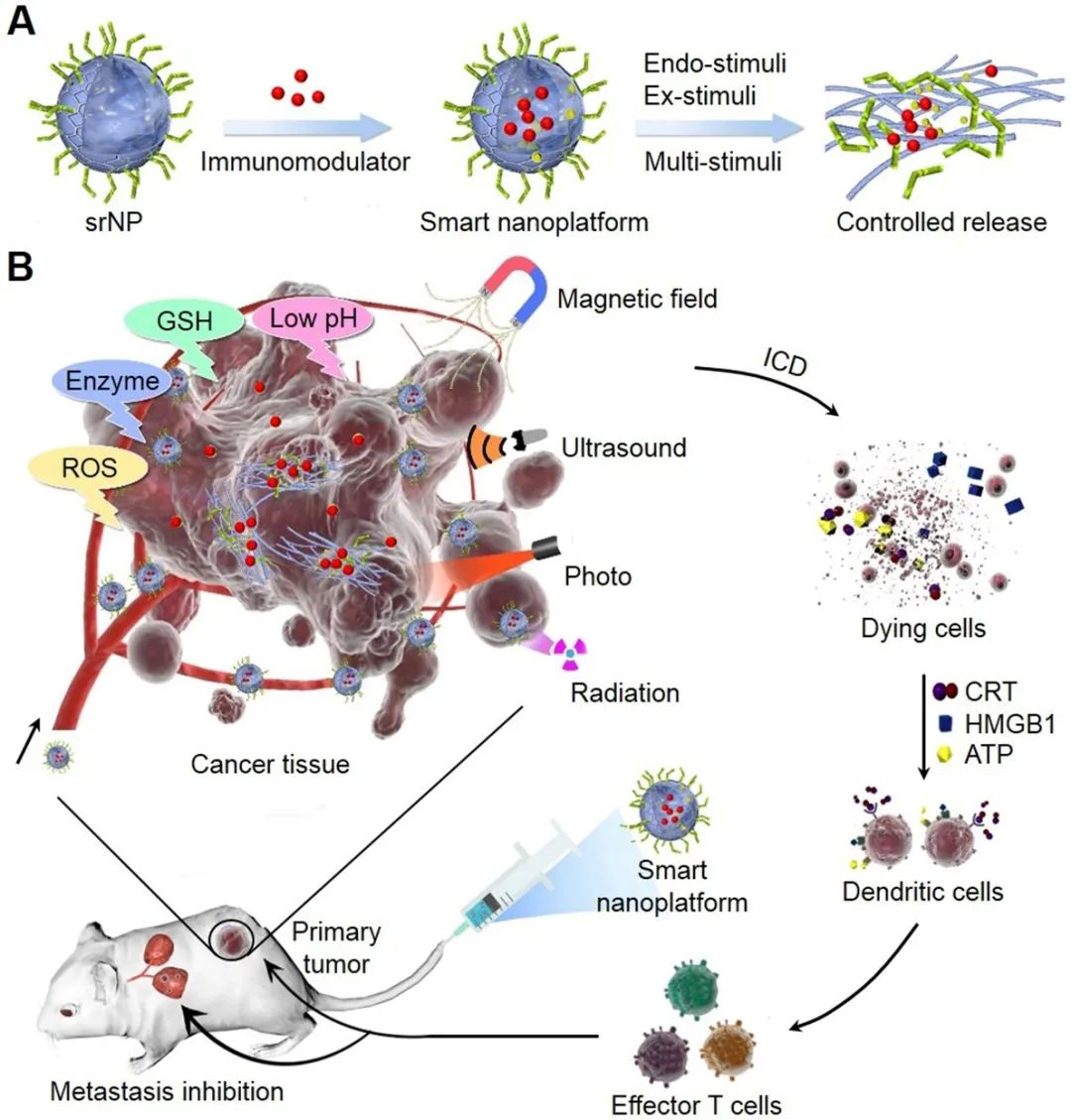
圖1:刺激響應(yīng)型納米粒子用于可控藥物釋放實(shí)現(xiàn)腫瘤的協(xié)同免疫治療。(A) 內(nèi)/外刺激響應(yīng)型納米粒子用于智能藥物釋放。(B) 刺激響應(yīng)型納米粒子在腫瘤微環(huán)境(弱酸性、酶、高活性氧/谷胱甘肽濃度)或外部局部刺激(近紅外光、超聲、磁場、X射線)下可控釋放免疫調(diào)節(jié)劑殺死腫瘤細(xì)胞,用于原發(fā)和轉(zhuǎn)移腫瘤治療。腫瘤死亡細(xì)胞過表達(dá)的CRT、HMGB1和ATP免疫信號被樹突細(xì)胞捕獲,呈遞給效應(yīng)T細(xì)胞(CD8+和CD4+T細(xì)胞)以攻擊原發(fā)和轉(zhuǎn)移性癌癥。
近年來,納米科技和腫瘤免疫學(xué)領(lǐng)域的結(jié)合促使各類抗腫瘤藥物呈現(xiàn)多功能化。提高藥物遞送的高效性、準(zhǔn)確性、有用性,一直是納米藥物研究的方向。與納米技術(shù)結(jié)合的藥物呈現(xiàn)以腫瘤位點(diǎn)智能識別并驅(qū)動功能化納米藥劑,結(jié)合不同的治療手段實(shí)現(xiàn)腫瘤的診斷治療防御一體化,將最大程度地減少抗腫瘤藥物的副作用,增大抗腫瘤藥物的利用率,以及增強(qiáng)清除腫瘤細(xì)胞的能力。腫瘤微環(huán)境是一個復(fù)雜的有別于正常細(xì)胞與其周圍組織所形成的微環(huán)境,可作為特定的識別點(diǎn)。腫瘤組織的酸性、高濃度谷胱甘肽、大量酶的產(chǎn)生及高溶度的活性氧等構(gòu)成了腫瘤組織代謝環(huán)境的生物學(xué)特征,這種特性對于腫瘤的增殖、侵襲、遷移、黏附能力及新生血管的形成具有重要影響。為提高納米顆粒治療腫瘤的效果,大量研究致力于設(shè)計(jì)腫瘤微環(huán)境響應(yīng)藥物傳遞平臺。
通過微環(huán)境響應(yīng)的雙硫鍵、雙硒鍵、腙鍵以及基質(zhì)金屬蛋白酶肽等修飾的聚合物載體可以用來載藥,這類藥物在正常組織中生物相容性高,且不會釋放藥物。當(dāng)這種納米粒子積累到腫瘤微環(huán)境時,就會產(chǎn)生反應(yīng)導(dǎo)致結(jié)構(gòu)變化,從而智能釋放藥物。如圖1所示,酸響應(yīng)型納米粒子表面的PEG可以增強(qiáng)穩(wěn)定性,防止藥物在體內(nèi)循環(huán)中泄漏和降解;到達(dá)腫瘤弱酸性的腫瘤微環(huán)境后(pH:6.8?7.0),酰胺鍵被裂解并脫落PEG層,減小納米粒子尺寸從而暴露帶正電的PEI中間層。膠束尺寸的減小和電荷的增加對于提高腫瘤滲透和細(xì)胞攝取是至關(guān)重要的;內(nèi)吞之后,聚(2-甲基丙烯酸乙酯(PDEA)核會在pH:4.5?6.0的內(nèi)溶酶體中快速質(zhì)子化,導(dǎo)致納米載體解體及藥物釋放;最后,釋放的siPD-L1藥物可沉默免疫檢查點(diǎn)基因PD-L1,從而增強(qiáng)免疫響應(yīng)協(xié)同抑制腫瘤生長。體內(nèi)/外模擬不同pH環(huán)境可以明顯看到納米粒子不同形態(tài)的變化,表明pH響應(yīng)下納米粒子的釋放行為及協(xié)同免疫治療腫瘤的效果。
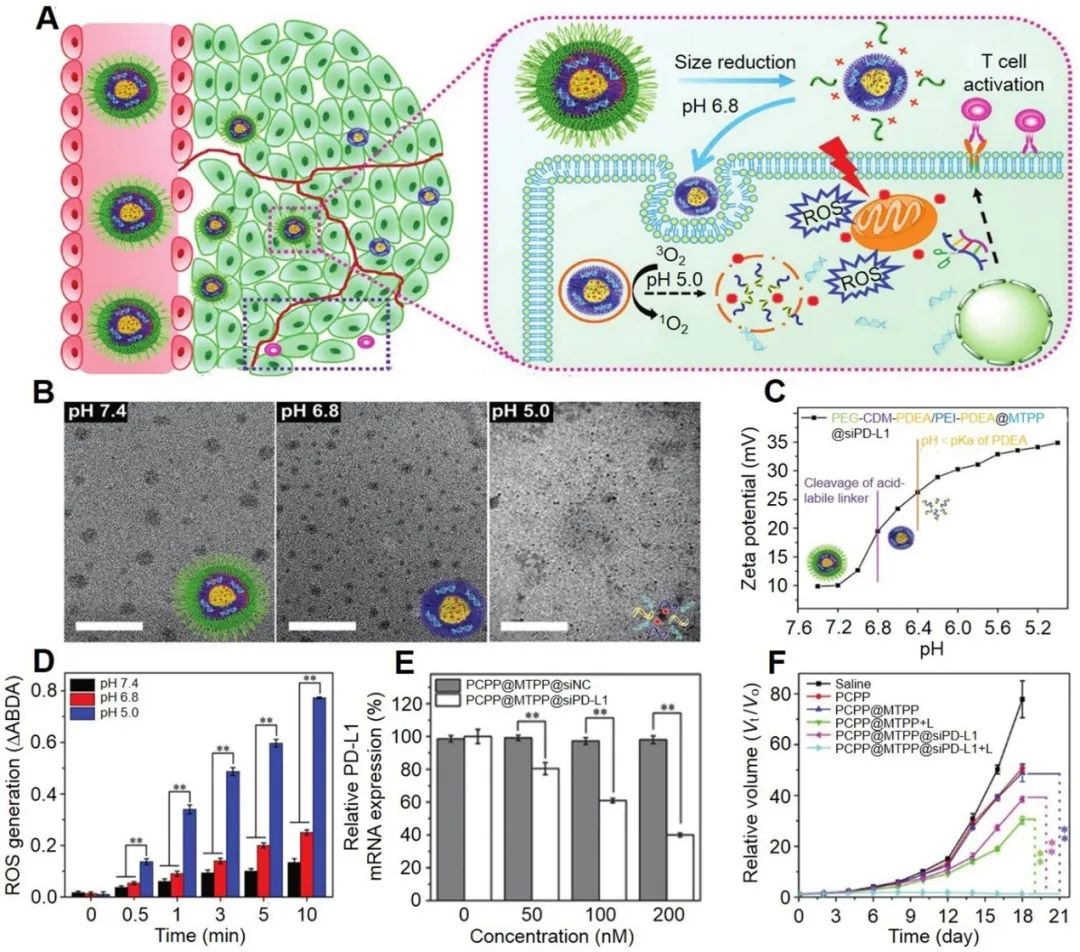
圖2. pH響應(yīng)型納米粒子用于藥物釋放控制和協(xié)同癌癥免疫治療。[16]
功能化納米藥物還可通過體外局部的光、超聲、磁場、X射線發(fā)生響應(yīng)促使藥物釋放。納米藥物一旦被人體吸收后會通過被動或主動靶向積累到腫瘤位置,并經(jīng)過局部外場照射后使分布在腫瘤位置的藥物釋放出來產(chǎn)生藥物效果。局部的近紅外或者X射線等也能直接或間接地殺死部分腫瘤細(xì)胞,引發(fā)腫瘤細(xì)免疫原性死亡,協(xié)同光治療、藥物治療、免疫治療等多重治療殺死腫瘤(如圖2)。外部刺激的智能納米醫(yī)藥為腫瘤治療所面臨的難題提供新思路,為腫瘤的協(xié)同治療取得戰(zhàn)略性意義,給醫(yī)學(xué)帶來巨大影響。
一些官能團(tuán)比如鄰硝基芐基、二磺酰氯、二烷氧基等可以在光照下裂解或降解,促使納米粒子的結(jié)構(gòu)發(fā)生變化,從而使得藥物特異性釋放。此外,光敏材料比如二氫卟吩(Ce6)在光照下產(chǎn)生活性氧引發(fā)光動力治療,或者光敏劑多次甲基菁在光照下升高局部溫度引發(fā)光熱治療。除了腫瘤位置局部光照外,超聲誘導(dǎo)內(nèi)細(xì)胞膜和表面細(xì)胞膜之間的振蕩壓力以產(chǎn)生膜孔,從而加強(qiáng)藥物在癌細(xì)胞膜內(nèi)的滲透和釋放。在超聲條件下,納米粒子表現(xiàn)出明顯的結(jié)構(gòu)塌陷,呈現(xiàn)控制藥物釋放的狀態(tài)。
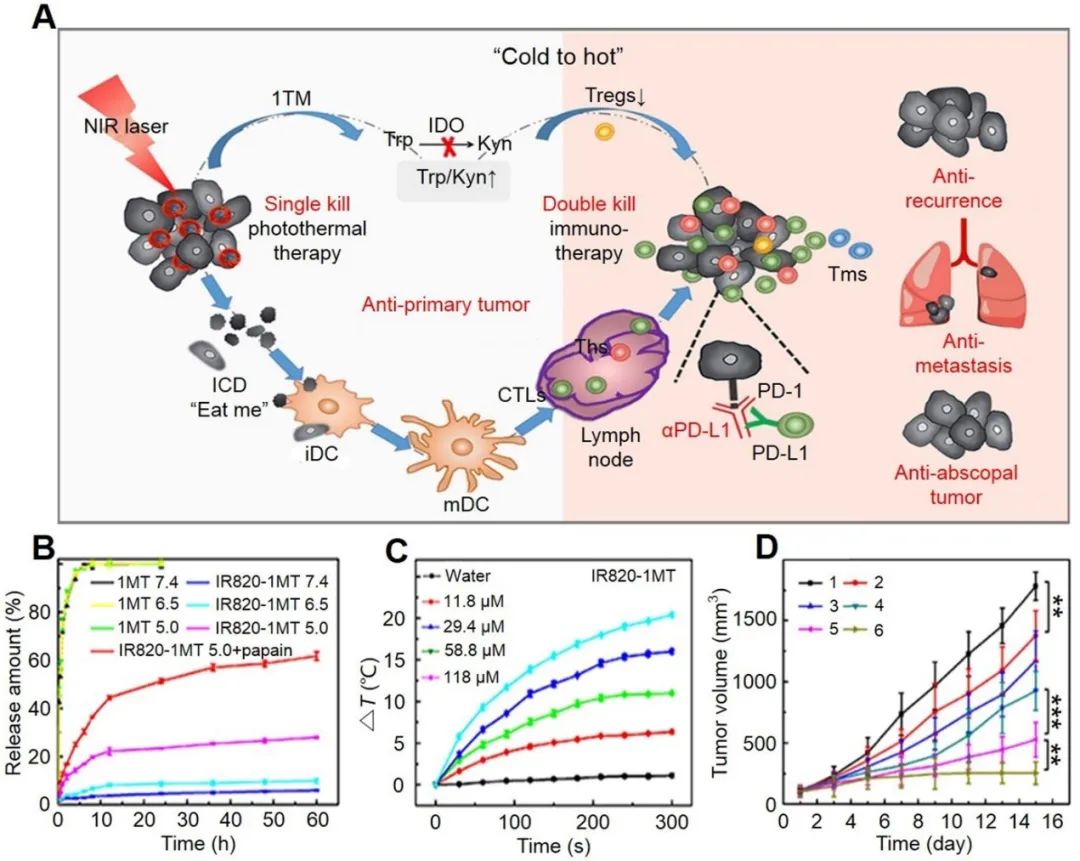
圖3. 光響應(yīng)型納米粒子用于可控藥物釋放和協(xié)同癌癥免疫治療。[163]
輻射是指電離、粒子或電磁輻射用于殺死癌細(xì)胞并防止癌細(xì)胞擴(kuò)散。在X射線照射下,脂質(zhì)體膜可被空穴化漲破導(dǎo)致釋放藥物。同時,對X射線響應(yīng)的含有S-S或Se-Se鍵的材料還可作為藥物遞送的納米載體。與輻射介導(dǎo)響應(yīng)相比,磁場幾乎不與身體相互作用,被認(rèn)為是納米載體的最佳外部觸發(fā)器之一。磁介導(dǎo)刺激響應(yīng)型納米粒子暴露在變化的磁場中,可以將電磁波轉(zhuǎn)化為熱能以進(jìn)一步引發(fā)藥物釋放和磁熱治療。總的來說,外部刺激響應(yīng)型納米粒子不僅能夠促使納米粒子在腫瘤位置精準(zhǔn)的釋放,其外部的輻射本身亦能作為一種治療手段在一定程度殺死腫瘤細(xì)胞。同時,殺死的腫瘤細(xì)胞能夠釋放相關(guān)免疫因子與藥物,以實(shí)現(xiàn)對腫瘤的高效協(xié)同免疫治療。
三、多級響應(yīng)型納米粒子設(shè)計(jì)具有多重響應(yīng)的刺激響應(yīng)型納米粒子可以同時多方面改變腫瘤位置的物理化學(xué)環(huán)境,這種對腫瘤環(huán)境的破壞使得腫瘤自身防御機(jī)制變得脆弱甚至崩潰。相比于單級刺激響應(yīng)型納米粒子,多級刺激響應(yīng)型納米粒子對藥物控制釋放變得更加智能、高效,是一種理想的藥物傳遞載體。內(nèi)源性化學(xué)環(huán)境的變化主要包括腫瘤自身形成的弱酸性被中和、高濃度的谷胱甘肽被消耗、活性氧以及酶反應(yīng)等。外部引發(fā)的物理改變有腫瘤的局部溫度升高、表面細(xì)胞膜之間的壓力改變等。如圖3,被細(xì)胞攝取的多級響應(yīng)型納米粒子經(jīng)過外部光照后在產(chǎn)生活性氧、酸性中和、局部溫度升高的腫瘤微環(huán)境下同時釋放抗腫瘤藥物,以引發(fā)高效協(xié)同治療的效果。
這種刺激響應(yīng)型納米粒子中和腫瘤酸性后,可以促進(jìn)免疫細(xì)胞浸潤到腫瘤中;過多的谷胱甘肽被消耗后可以破壞腫瘤的抗氧化防御系統(tǒng);雙氧水與腫瘤的發(fā)生、發(fā)展關(guān)系密切,其既會促使細(xì)胞癌變,又會促進(jìn)腫瘤細(xì)胞浸潤和轉(zhuǎn)移。但另一方面,細(xì)胞內(nèi)雙氧水濃度的過高或過低又會促使腫瘤細(xì)胞凋亡。研究結(jié)果表明,免疫調(diào)節(jié)劑負(fù)載的刺激響應(yīng)型納米粒子對患者的治療效果遠(yuǎn)遠(yuǎn)超過了單純使用免疫藥物的治療,為此更多的研究正在進(jìn)一步優(yōu)化刺激響應(yīng)在藥物智能釋放和協(xié)同免疫治療方向的結(jié)合價值。值得注意的是,多級刺激響應(yīng)型納米粒子集合了多個控制釋放點(diǎn)、極大程度地破壞腫瘤微環(huán)境、增強(qiáng)調(diào)節(jié)藥物釋放敏感度,以及促進(jìn)腫瘤的治療與免疫響應(yīng)能力,為研發(fā)免疫治療機(jī)制和多方位智能材料新科學(xué)以延長腫瘤患者生命提供新的機(jī)遇。
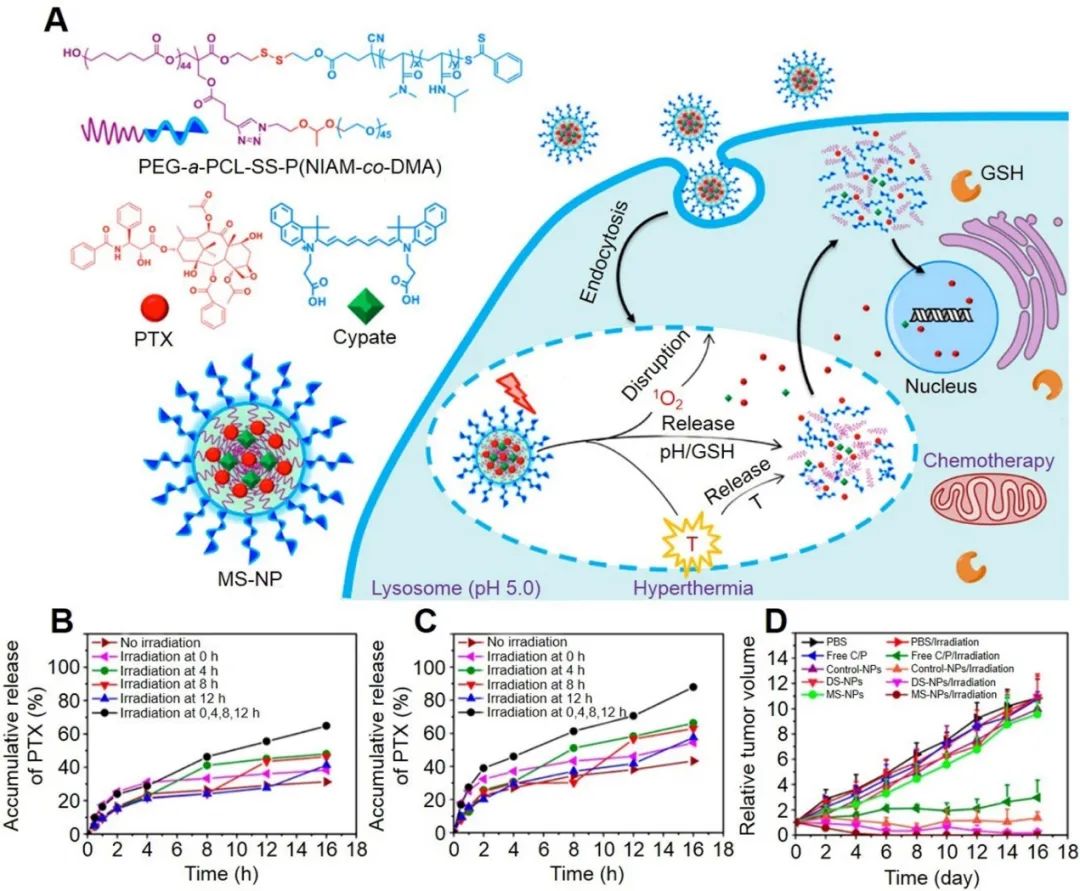
圖4. 多級刺激響應(yīng)型納米粒子用于可控藥物釋放和協(xié)同免疫治療。[246]
福州大學(xué)石油化工學(xué)院、清源創(chuàng)新實(shí)驗(yàn)室生物分析與納米醫(yī)學(xué)科研團(tuán)隊(duì)成員張進(jìn)教授、碩士生林延帶。福州大學(xué)化學(xué)學(xué)院、清源創(chuàng)新實(shí)驗(yàn)室生物分析與納米醫(yī)學(xué)科研團(tuán)隊(duì)負(fù)責(zé)人楊黃浩教授、宋繼彬教授和中科院長春應(yīng)化所丁建勛教授。

該工作得到國家自然科學(xué)基金、福建省自然科學(xué)基金、清源創(chuàng)新實(shí)驗(yàn)室重點(diǎn)項(xiàng)目、高分子材料科學(xué)工程國家重點(diǎn)實(shí)驗(yàn)室(四川大學(xué))開放課題等基金的資助。并感謝福建省雛鷹計(jì)劃青年拔尖人才項(xiàng)目及福建省科協(xié)青年托舉人才項(xiàng)目的大力支持。




 閩公網(wǎng)安備35050502100027
閩公網(wǎng)安備35050502100027